Principe
La mutagenèse dirigée consiste à introduire des mutations (insertions, délétions et substitutions) spécifiques et ciblées au niveau d’un ADN plasmidique double brin. Elle présente de nombreuses applications, notamment les suivantes :
- Étude des changements d’activité protéique résultant de la modification de l’ADN ;
- Sélection ou criblage de mutations (au niveau de l’ADN, de l’ARN ou de la protéine) présentant une propriété recherchée ;
- Ajout ou suppression de sites d’endonucléase de restriction ou de tags.
La mutagenèse dirigée est un processus in vitro qui utilise des amorces oligonucléotidiques spécifiquement conçues pour créer la mutation désirée dans un plasmide. Par le passé, une méthode mise au point par Kunkel en 1985 était largement répandue. Dans cette approche, une souche d’E. coli déficiente en dUTPase et en uracile-ADN glycosylase est utilisée pour produire des copies uracilées de l’ADN d’intérêt. Ces dernières sont ensuite introduites dans une souche sauvage, où elles servent de matrice – en présence d’une amorce portant la mutation désirée – pour la synthèse d’un ADN muté, avant d’être dégradées.
Aujourd’hui, il existe sur le marché un certain nombre de kits qui nécessitent également une modification et/ou des souches d’E. coli spécifiques (par exemple, Phusion Site-Directed Mutagenesis® Kit et le système GeneArt® de Thermo Fisher Scientific). Les méthodes les plus couramment utilisées ne requièrent aucune modification ou souche particulière : les mutations sont incorporées dans le plasmide par PCR inverse à l’aide d’amorces standards, qui peuvent être conçues soit avec un chevauchement (QuikChange®, Agilent), soit avec une orientation dos à dos (Q5® Site-Directed Mutagenesis Kit) (figure 1).
Des amorces chevauchantes donnent lieu à un produit qui se recircularise ensuite pour former un plasmide comportant deux coupures simple brin. Malgré la présence de ces dernières, ce produit circulaire peut être utilisé directement pour transformer E. coli, avec une efficacité toutefois inférieure par rapport à un plasmide intact. Les méthodes axées sur des amorces dos à dos offrent non seulement l’avantage de produire des plasmides sans coupures, mais permettent également de générer une quantité bien plus importante du produit désiré, grâce à une amplification exponentielle (figure 2). De plus, comme les amorces ne se chevauchent pas, la taille des délétions n’est limitée que par le plasmide ; et la longueur des insertions, par les contraintes de la synthèse d’oligonucléotides. À l’heure actuelle, en répartissant les bases à ajouter entre les deux amorces, des insertions allant jusqu’à 100 pb peuvent être réalisées en une étape avec cette méthode.
Avant de concevoir les amorces, il est important de déterminer les étapes de mutagenèse à suivre. Nous présentons ici une comparaison de trois kits disponibles sur le marché (figure 3), ainsi qu’une brève description de leurs principales caractéristiques.
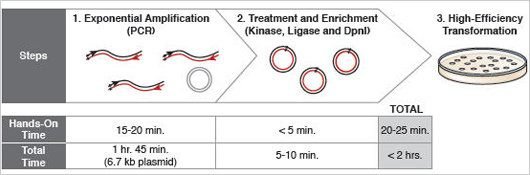
Figure 1 : Mutagenèse dirigée en moins de 2 heures.
Grâce à l’utilisation d’un master mix, du KLD Enzyme Mix – un mélange d’enzymes unique – et d’une polymérase rapide, la réaction de mutagenèse est complète en moins de deux heures pour la plupart des plasmides.
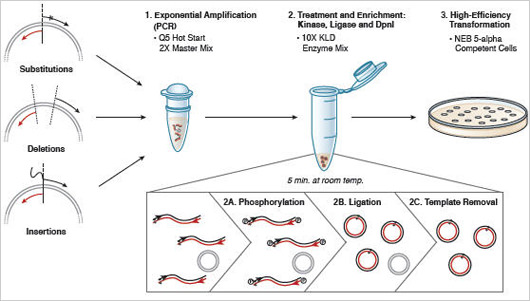
Figure 2 : Principe de Q5 Site-Directed Mutagenesis Kit.
Ce kit est conçu pour la réalisation rapide et efficace d’insertions, de délétions et de substitutions au niveau d’un ADN plasmidique double brin. Première étape : amplification exponentielle à l’aide d’amorces standards et d’un master mix contenant Q5 Hot Start High-Fidelity DNA Polymerase. Deuxième étape : incubation avec un mélange d’enzymes unique contenant une kinase, une ligase et DpnI, permettant la circularisation rapide du produit de PCR et l’élimination de l’ADN matrice. Troisième étape : transformation efficace de cellules chimiquement compétentes (fournies).
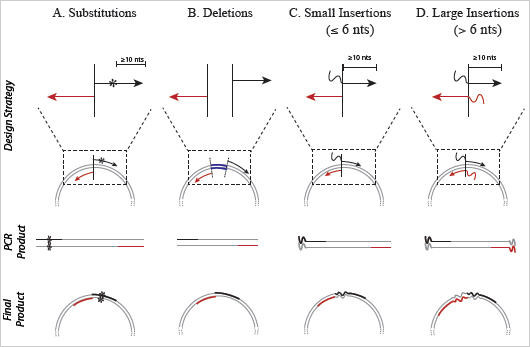
Figure 3 : Conception d’amorces pour Q5 Site-Directed Mutagenesis Kit
Les substitutions, les délétions et les insertions sont introduites dans l’ADN plasmidique à l’aide d’amorces sens (en noir) et antisens (en rouge) spécifiquement conçues. Contrairement aux kits reposant sur une amplification linéaire, Q5 Site-Directed Mutagenesis Kit nécessite des amorces qui ne se chevauchent pas, de façon à permettre une amplification exponentielle. A) Les substitutions sont réalisées en intégrant les mutations désirées (indiquées par le symbole *) au centre de l’amorce sens, suivies d’au moins 10 nucléotides en 3′. L’amorce antisens est conçue pour un appariement dos à dos des extrémités 5′ des deux amorces. B) Les délétions sont effectuées en développant des amorces sens et antisens standards non mutagènes qui encadrent la région à supprimer. C) Les insertions de 6 nucléotides ou moins sont intégrées à l’extrémité 5′ de l’amorce sens, tandis que l’amorce antisens s’apparie dos à dos avec l’extrémité 5′ de la région complémentaire de l’amorce sens. D) Des insertions plus longues peuvent être réalisées en intégrant la moitié de la séquence désirée aux extrémités 5′ de chacune des deux amorces. La taille maximale de l’insertion est principalement dictée par les limites de la synthèse d’oligonucléotides.
Comparaison avec un produit concurrent
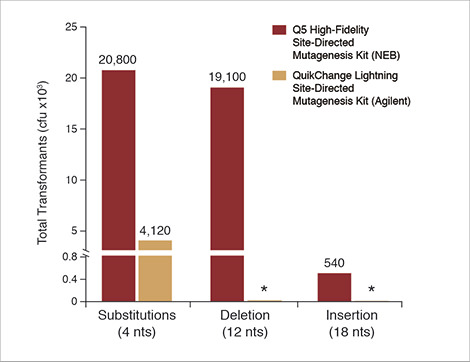
Q5 Site-Directed Mutagenesis Kit (NEB) offre une efficacité de transformation plus élevée que QuikChange® Lightning Site-Directed Mutagenesis Kit (Agilent)
Cette figure montre les résultats d’une substitution de 4 nt effectuée avec le Control SDM Primer Mix (amorces dos à dos) et le Control SDM Plasmid (6,7 kb), ainsi que ceux d’une délétion de 12 nt (plasmide de 5,8 kb) et d’une insertion de 18 nt (plasmide de 7,0 kb). Dans les trois cas, plus de 90 % des colonies comportent les mutations désirées. Les résultats sont exprimés en nombre total de transformants qui auraient été obtenus si les cellules n’avaient pas été diluées avant d’être étalées sur des boîtes de Pétri. Pour comparaison, la même substitution de 4 nt a été réalisée avec QuikChange Lightning Site-Directed Mutagenesis Kit (Agilent) selon le protocole du fournisseur et en utilisant son outil de conception d’amorces pour développer des amorces chevauchantes. *Remarque : le kit QuikChange ne permettant d’effectuer ni des délétions ni des insertions de cette taille, aucune comparaison n’a pu être établie pour ces expériences.
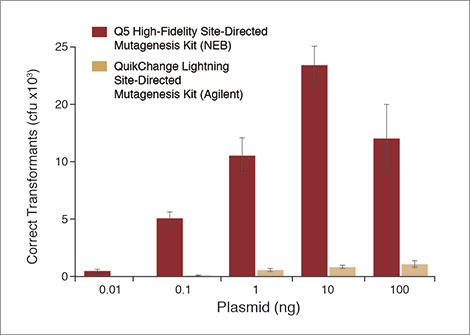
Q5 Site-Directed Mutagenesis Kit (NEB) donne un taux de transformants corrects supérieur à celui de QuikChange Lightning Site-Directed Mutagenesis Kit (Agilent)
Une substitution de 4 nt a été effectuée avec le Control SDM Primer Mix (amorces dos à dos) et les différentes quantités de Control SDM Plasmid (6,7 kb) indiquées. Pour comparaison, la même expérience a été réalisée avec QuikChange Lightning Site-Directed Mutagenesis Kit (Agilent) selon le protocole du fournisseur et en utilisant son outil de conception d’amorces du fournisseur pour développer des amorces chevauchantes. Les résultats sont exprimés en nombre total de transformants qui auraient été obtenus si les cellules n’avaient pas été diluées avant d’être étalées sur des boîtes de Pétri. Bien qu’il soit possible de réussir des expériences en dehors de cet intervalle, nous vous recommandons d’utiliser 0,1 à 100 ng de plasmide pour des résultats robustes.
Plus d’informations disponibles dans la section Ressources Techniques ou sur neb.com


